ड्रग्स एंड कॉस्मेटिक्स एक्ट: 84 साल पुराना कानून अब भी प्रासंगिक, लेकिन बड़े सुधारों की जरूरत — समझें पूरा मामला
नई चुनौतियाँ: ऑनलाइन फार्मेसी से लेकर नकली दवाओं तक

असर मीडिया हाउस डेस्क | हेल्थ पॉलिसी
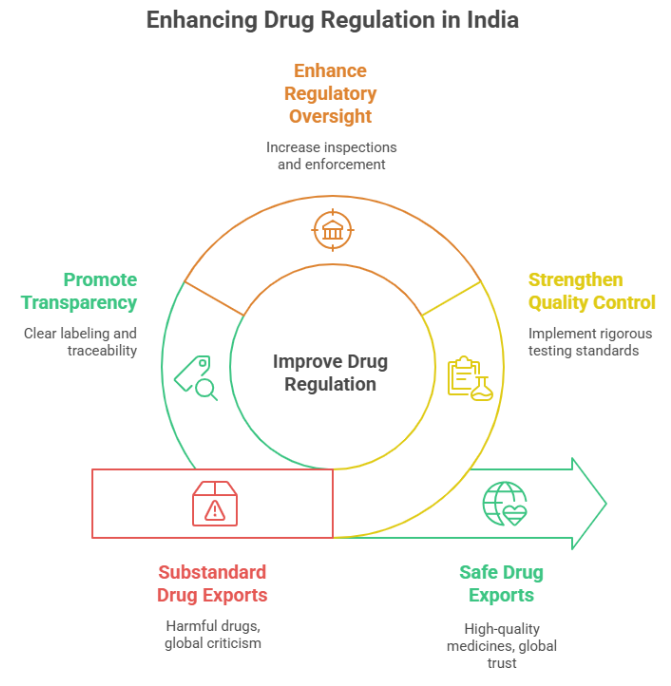
भारत में दवाओं और प्रसाधन सामग्रियों की गुणवत्ता, सुरक्षा और मानकों की निगरानी के लिए लागू ड्रग्स एंड कॉस्मेटिक्स एक्ट, 1940 को देश की सार्वजनिक स्वास्थ्य सुरक्षा की रीढ़ माना जाता है। लेकिन इस कानून के 80 से अधिक वर्ष बाद भी कई क्षेत्रों में बड़े सुधारों की मांग बढ़ती जा रही है। केंद्र सरकार अब एक नए व्यापक विधेयक—Drugs, Medical Devices and Cosmetics Bill—के माध्यम से इसे आधुनिक स्वरूप देने की दिशा में काम कर रही है।
क्यों बनाया गया था यह कानून?
1940 के दशक में भारत में नकली और घटिया दवाओं की बाढ़ जैसी स्थिति थी। दवाओं की गुणवत्ता जांचने का कोई सुदृढ़ ढांचा मौजूद नहीं था। इसी चुनौती से निपटने के लिए संसद ने ड्रग्स एंड कॉस्मेटिक्स एक्ट, 1940 लागू किया।
इसका उद्देश्य था—
-
नकली, मिलावटी और असुरक्षित दवाओं पर रोक
-
दवाओं के निर्माण, बिक्री और आयात को नियंत्रित करना
-
कॉस्मेटिक्स की सुरक्षा सुनिश्चित करना
कैसे लागू होता है यह कानून?
लाइसेंसिंग सिस्टम
दवा बनाने वाली हर फैक्ट्री को राज्य लाइसेंसिंग अथॉरिटी से लाइसेंस लेना अनिवार्य है। वहीं आयातित दवाओं की अनुमति केंद्र यानी CDSCO जारी करता है।
शेड्यूल सिस्टम
इस कानून के तहत दवाओं को विभिन्न शेड्यूल में बांटा गया है—
-
Schedule H / H1: केवल डॉक्टर के पर्चे पर मिलने वाली दवाएं
-
Schedule X: नशीली व अत्यधिक नियंत्रित दवाएं
-
Schedule M: दवा निर्माण के लिए GMP मानक
-
Schedule Y: क्लिनिकल ट्रायल के नियम
दंड
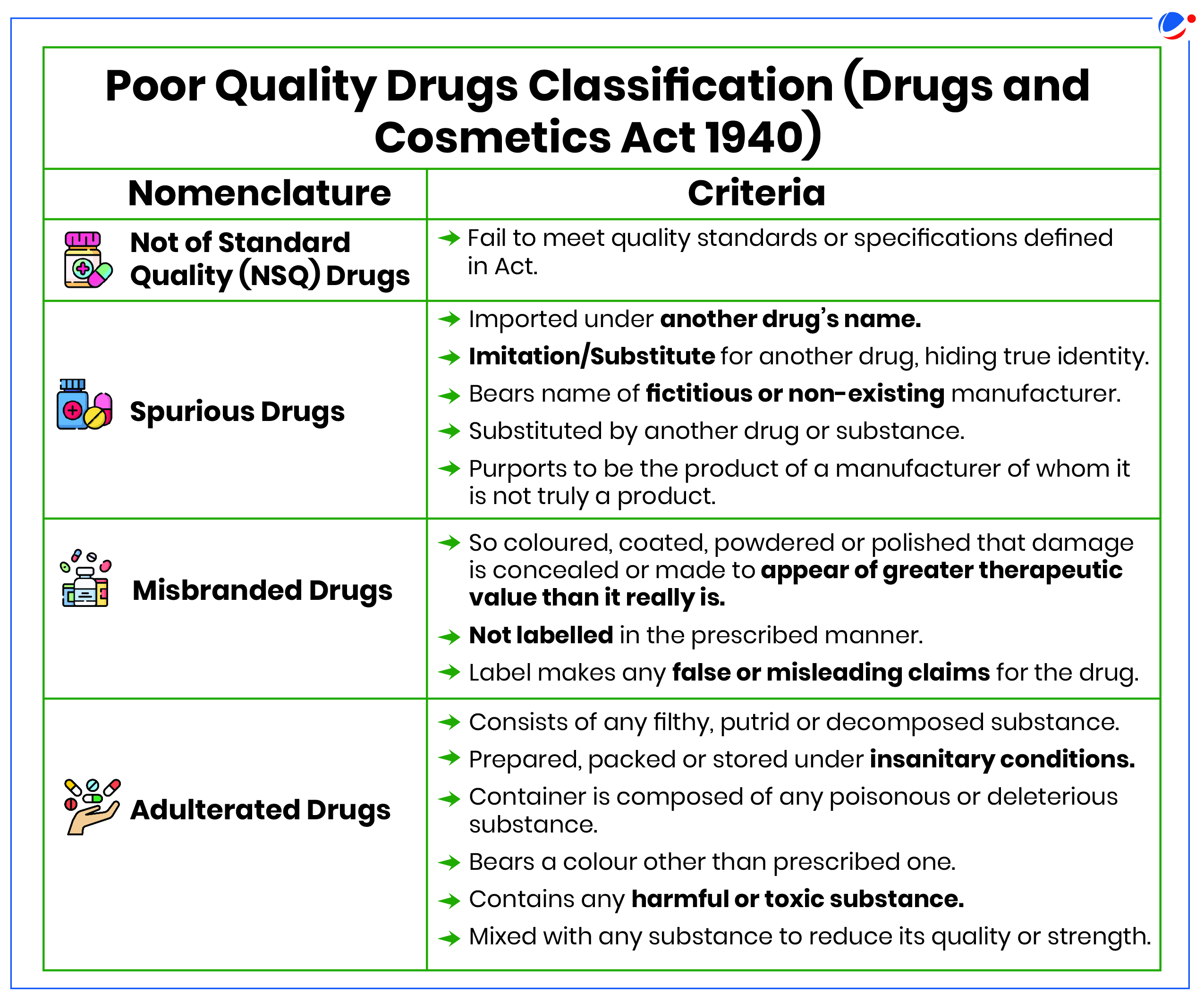
मिलावटी या नकली दवा बनाने/बेचने पर कड़े दंड का प्रावधान है, कुछ मामलों में आजीवन कारावास तक हो सकता है।
वर्षों में क्या-क्या संशोधन हुए?
1964 संशोधन — AYUSH शामिल
आयुर्वेद, यूनानी, सिद्ध दवाओं को पहली बार इस अधिनियम में शामिल किया गया।
1982 संशोधन — कठोर दंड
दवा निरीक्षकों की शक्तियाँ बढ़ीं, और नकली दवाओं पर दंड कठोर किए गए।
1995 — Schedule M अपडेट
दवा निर्माण मानकों को WHO-GMP स्तर पर लाया गया।
2005 — Schedule Y संशोधन
क्लिनिकल ट्रायल के नियम अंतरराष्ट्रीय मानकों के अनुसार अपडेट किए गए।
2013 — Schedule H1 लागू
एंटीबायोटिक दुरुपयोग रोकने के लिए 3rd/4th जनरेशन एंटीबायोटिक्स को H1 श्रेणी में लाया गया।
2017 — Medical Device Rules लागू
स्टेंट, पेसमेकर, सीरिंज, इम्प्लांट जैसी मेडिकल डिवाइसेज को दवा की श्रेणी में लाकर अलग नियम बनाए गए।
नई चुनौतियाँ: ऑनलाइन फार्मेसी से लेकर नकली दवाओं तक
डिजिटल दौर में नई चुनौतियाँ भी सामने आई हैं:
-
ऑनलाइन फार्मेसी की अनियमितता
-
नकली दवाओं की बढ़ती समस्या
-
राज्यों की निरीक्षण क्षमता में असमानता
-
क्लिनिकल ट्रायल से जुड़े विवाद
-
मेडिकल डिवाइस की सुरक्षा को लेकर लगातार शिकायतें
स्वास्थ्य विशेषज्ञों के अनुसार, 1940 का कानून इन सभी मुद्दों का पूर्ण समाधान नहीं दे पाता।
नई ड्राफ्ट Bill की तैयारी: क्या-क्या बदलेगा?
सरकार Drugs, Medical Devices and Cosmetics Bill (2023/2025) के मसौदे पर तेजी से काम कर रही है।
इस नए बिल में—
-
मेडिकल डिवाइस के लिए अलग व्यापक कानून
-
ऑनलाइन फार्मेसी के लिए स्पष्ट दिशानिर्देश
-
दंड और अधिक कठोर
-
नई दवा (New Drug) की परिभाषा और परीक्षण प्रणाली आधुनिक
-
गुणवत्ता निगरानी तंत्र और मजबूत
नई व्यवस्था लागू होने पर भारत की दवा नियमन प्रणाली को 21वीं सदी की जरूरतों के अनुरूप बताया जा रहा है।
निष्कर्ष
ड्रग्स एंड कॉस्मेटिक्स एक्ट ने भारत में फार्मास्यूटिकल क्वालिटी कंट्रोल की नींव रखी। लेकिन तकनीक, क्लिनिकल रिसर्च, ऑनलाइन कारोबार और मेडिकल डिवाइस सेक्टर के विस्तार के साथ अब यह अधिनियम पुराना पड़ चुका है। विशेषज्ञ मानते हैं कि नए कानून के माध्यम से भारत वैश्विक मानकों के अनुरूप एक आधुनिक, पारदर्शी और मजबूत दवा नियमन व्यवस्था हासिल कर सकता है।